Apfelbatterie-Experiment
Infos zum Experiment
Bis 10 Jahre
11 bis 14 Jahre
Bis zu 30 Minuten
Mit freundlicher Genehmigung von www.DLR.de/next
Materialien
Zusatzanschaffungen2 saure Äpfel
5 Kupferdrähte
1 flaches Stück Kupferblech
1 Leuchtdoide
1 flaches Stück Zinkblech
Beschreibung des Experiments
Achtung: Bitte esst die Äpfel nach der Benutzung in diesem Experiment nicht mehr, denn der Vorgang erzeugt in ihnen giftige Stoffe! Ihr könnt übrigens auch Zitronen oder andere säurehaltige Früchte für diesen Versuch verwenden. Das Obst muss aber in jedem Fall direkt nach dem Versuch in den Müll geworfen werden! Sprecht mit euren Eltern, bevor ihr mit dem Experiment beginnt – und zeigt ihnen diesen Warnhinweis!
Kann man mit Obst Strom erzeugen? Mit dem folgenden Versuchsaufbau könnt ihr selbst herausfinden, ob das mit Hilfe von Äpfeln und einigen anderen „Zutaten“ klappt:
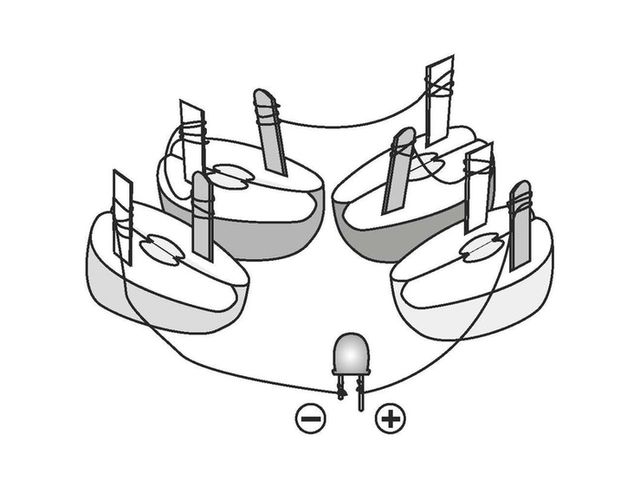
- Halbiert die beiden Äpfel.
- Teilt die Zink- und Kupferbleche in jeweils 4 gleichgroße Plättchen (beide Bleche sollten 24 cm lang sein).
- Steckt die Plättchen in die Apfelhälften hinein – am besten nicht zu weit voneinander entfernt.
- Benutzt nun die Kupferdrähte (je 15 cm lang), um die Kupfer- und Zinkplättchen zu verbinden. Ein Zinkplättchen wird jeweils mit dem Kupferplättchen eines anderen Apfels verbunden.
- Zuletzt verbindet ihr die übrigen zwei Plättchen mit der Leuchtdiode. Dabei gehört das Kupferplättchen an den Plus-Pol der Diode und das Zinkplättchen an den Minus-Pol.
- Jetzt sollte eure Leuchtdiode leuchten.
Erklärung
Die Säure im Fruchtsaft reagiert mit den Metallen. Und zwar entstehen dabei positiv geladene Metall-Teilchen, sogenannte Ionen. Je edler ein Metall ist, um so schlechter geht das. Kupfer ist edler als Zink. Es entstehen daher in der gleichen Zeit weniger (positive) Kupfer-Ionen als (positive) Zink-Ionen. So hat das Zinkplättchen im Vergleich zum Kupferplättchen nach einiger Zeit einen Überschuss an negativen Ladungen (Elektronen).
Sobald die beiden Metalle mit einem Draht verbunden sind, fließen darum negative Ladungen vom Zink zum Kupfer. Und wenn das passiert, fließt eben Strom. Wir haben also einen elektrischen Stromkreis. Aber nur so lange, bis die Säure des Apfels aus beiden Metallen keine Ionen mehr herauslösen kann. In unserem Experiment haben wir gleich vier Batterien hintereinander geschaltet um eine höhere Spannung zu erzeugen.
Das Experiment funktioniert auch mit anderen Früchten oder Säuren. Aber es kommt darauf an, welche Metalle ihr verwendet: Die elektrische Energie kommt nämlich nicht aus dem Apfel, sondern entsteht wegen der Eigenschaften der Metalle.
Fotoquelle: DLR
Bestätigen für mehr Datenschutz:
Erst wenn Sie auf OK klicken, können Sie den Artikel auf empfehlen. Nach Ihrer Empfehlung werden keinerlei Daten mehr an oder Dritte gesendet.
Mehr dazu hier: Datenschutzerklärung